1、 常见的金属活性顺序表
在初学化学的时候,就学习过金属活性顺序表。并从中知道,前面的金属可以把后面的金属从他们的可溶性盐中置换出来(除K、Ca、Na)
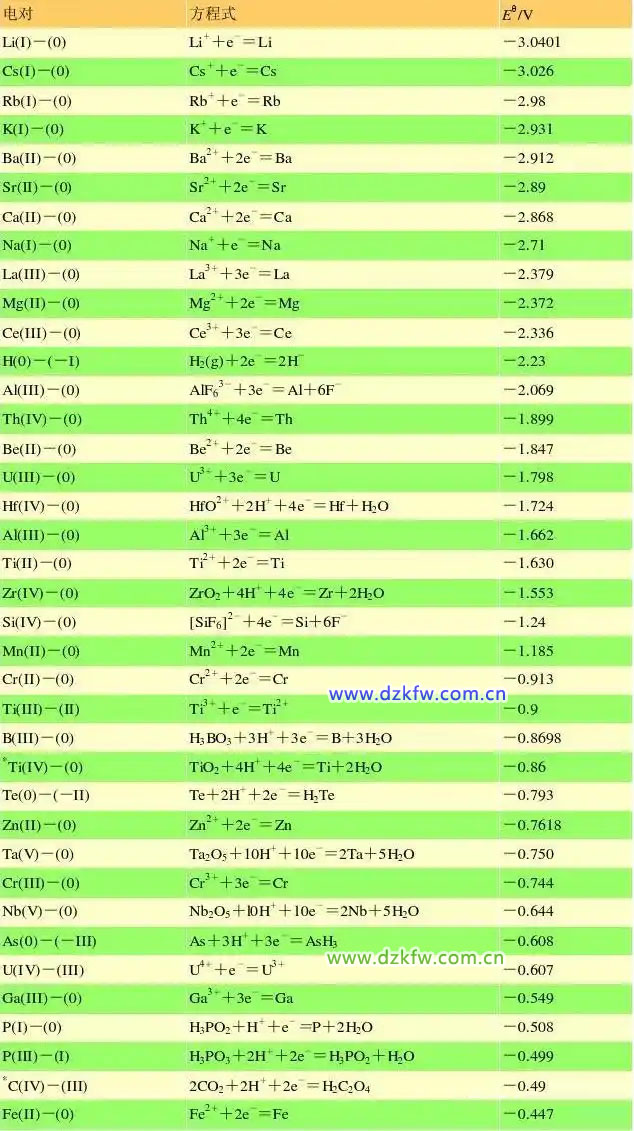
金属活性顺序表
可是,这样的金属活动性顺序表,你见过吗?
从这张表中,身为锂电池从业者的你发现了什么?是不是特别刺眼?锂!锂!锂!居然位于表头,我的天呢,这是什么鬼?
镁铜组成原电池中,镁为负极,可以置换出铜,这是是毫无疑问的,这也是我们经常用来判断两种金属活泼性常用方法。
那么,锂和镁组成标准的原电池锂是负极,并置换出镁吗?
Yes,You are right!
2、金属性越强的金属与酸或水反应就越剧烈?
接下来,问题来了,金属活动性最强的确是锂,它与酸或水反应就越剧烈吗?这个就未必!是的,未必!
(1)金属活动性是个热力学标准,由标态下的金属的电极电势决定,φθ(Li+/Li) =-3.042V,若把金属Li排到金属活动性顺序表中,自然就排在最前面了。
Li的水化热最负,造成了锂的电极电势最低,并不代表Li的金属性最强。
另外锂电势最负,与其原子结构有关,及发生反应的难易程度有关(能量变化)。锂(Li)的原子核外共有3个电子,第1电子层有2个电子,最外电子层有1个电子。
(2)活泼性越强的金属与水或酸反应的快、慢,是一动力学范畴,金属性越强,一般反应越剧烈。
为什么Li与水的反应慢,原因简析如下
ü LiOH的溶解度小,包覆在Li的表面,阻碍了反应的进一步进行,宏观上看,就是和水反应不剧烈
ü Li熔点高,反应产生的热不足以使Li熔化,因而固态的Li与水的接触面不如液态的大
ü Li+的水合半径打,移动缓慢,难以扩散到溶液的本体里去,致使反应速率减慢
3、 锂-电池材料之首选
φθ(Li+/Li) =-3.042V,为了提升安全性及电压,负极采用石墨及钴酸锂等材料来储存锂原子。这些材料的分子结构,形成了纳米等级的细小储存格子,可用来储存锂原子,以此,形成一个低电位电极。






 返回顶部
返回顶部 刷新页面
刷新页面 下到页底
下到页底